实验方法/体外透皮试验 (IVPT)
通过精确测量化合物在各皮肤层(图1)中的分布、渗透量和渗透速率,来探索早期吸收阶段的皮肤渗透性差异。该方法可以避免使用活体动物,并且对多个相同或不同的化合物进行多次重复测试,特别适用于比较化合物不同制剂的经皮给药筛选试验。另外,IVPT研究对于评估外用产品的生物等效性(Bioequivalence, BE)也至关重要。结合体外释放试验(In Vitro Release Testing, IVRT)结果,可以为皮肤局部外用药物处方等同性评价中的微观结构特性(Q3)的等同性评价提供重要的证据。
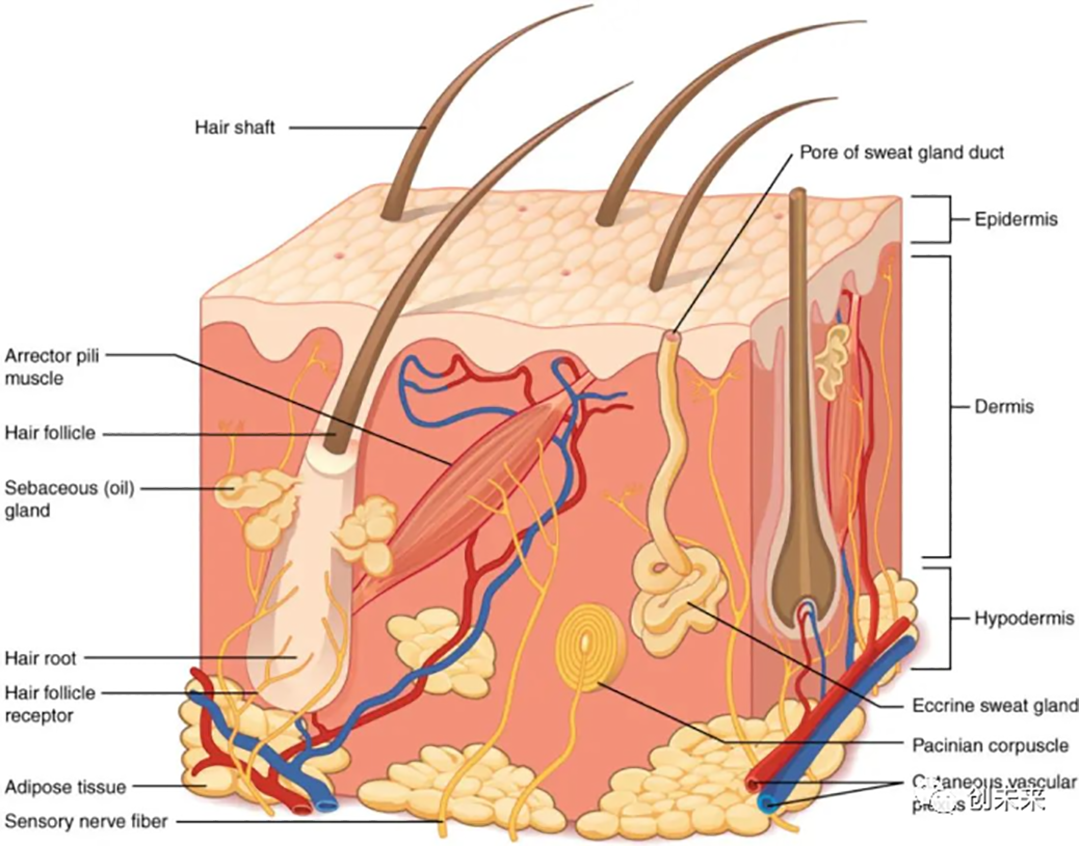
图1. 人体皮肤结构示意图[1]
IVPT试验常见的应用范围包括
1. 辅助早期化合物的筛选
2. 皮肤外用制剂的配方开发和优化
3. BE和生物利用度评估
4. 药品或化妆品的安全性评估
相关技术指导原则
2021年3月,国家食品药品监督管理局药品评审中心(Center for Drug Evaluation, CDE)发布了《皮肤外用化学仿制药研究技术指导原则(试行)》,明确了体外透皮试验的设计目的是模拟外用药物在生理条件下的透皮过程,以反映外用制剂的质量。在试验设计方面,相比于2018年发布的《新注册分类皮肤外用仿制药的技术评价要求(征求意见稿)》,新版指导原则删除了原附件的内容,并提出“体外透皮试验建议参考国内外相关指导原则开展相关研究工作”[2]。
表1.体外透皮试验相关指导原则
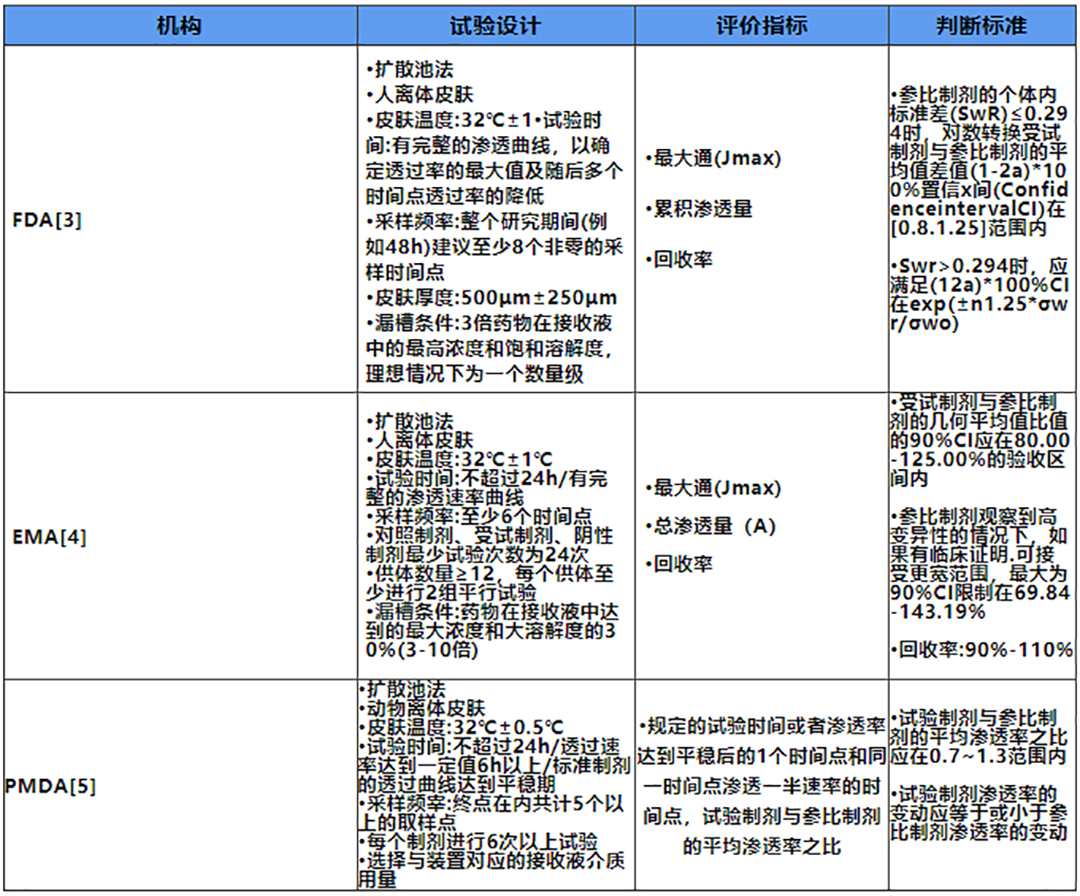
各指导原则的试验设计在实际应用时,还应综合考虑实际的实验目的和条件。在国内申报中,由于皮肤来源的限制,通常参考PMDA的相关设计。
如何选择和构建合适的皮肤模型
在皮肤材料的准备中,种属的选择是首先要面对的问题。虽然人离体皮肤是IVPT试验的金标准,但由于伦理及获取困难等原因,通常选取动物皮肤替代人离体皮肤来进行体外透皮试验。
目前的文献报道中,猪皮是和人类皮肤最为相似的,包括相似的角质层,表皮厚度及毛囊密度等[6,7]。不同种属动物皮肤的特点对比见下表2。
表2.不同动物种属皮肤特点的比较[6,7]
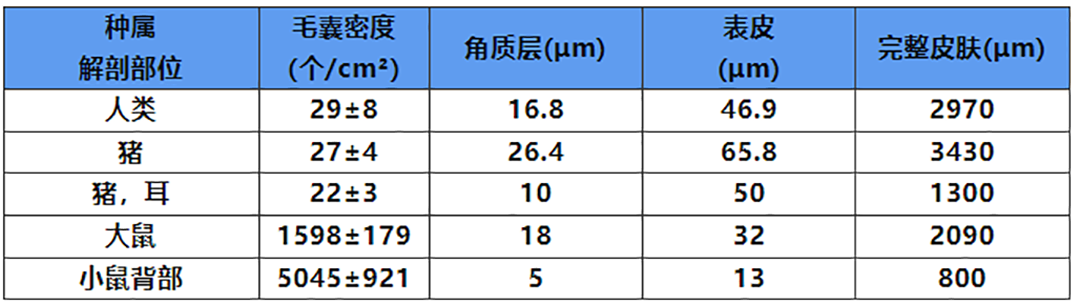
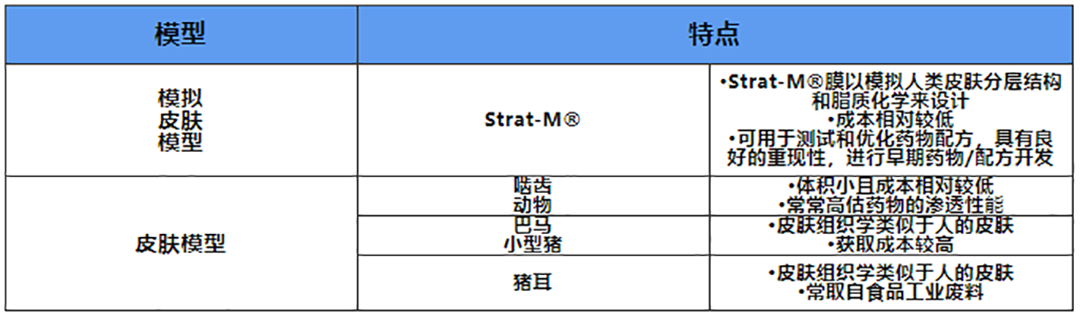
啮齿动物的皮肤是最容易获取的材料。然而,由于脂肪比例、毛囊密度等结构上的差异,药物在啮齿动物离体皮肤中的渗透参数高于人离体皮肤,从而导致对药物吸收的高估[8]。因此,在IVPT试验中首选的皮肤是和人类皮肤相似的巴马小型猪的离体皮肤。目前IVPT试验常用的皮肤模型如下表3。
表3.IVPT试验常用的皮肤模型
实验常用装置及参数设置
体外透皮试验常用的设备如下图4所示,包括垂直式静态扩散池(StaticCell, SC)和流通式扩散池(ContinuousFlowCell,CFC)。流通式扩散池具有连续流动的接收液,以模拟体内血液的流动情况,但由于新参数的引入,需要进行更多的预试验来确定相关试验参数。垂直式静态扩散池具有固定体积的接收室,试验过程中持续搅拌接收液,是我们实验室可选用的扩散池装置。
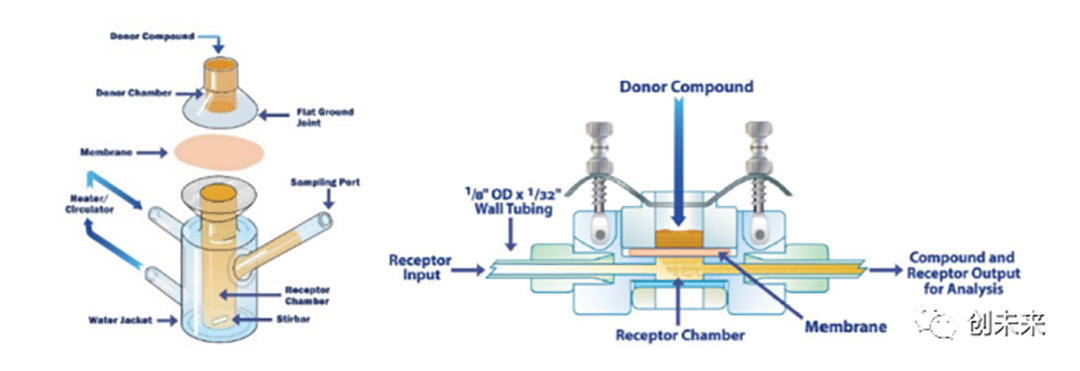
图2.常用扩散池示意图(SC:左,CFC:右
使用扩散池进行试验需要一个合适的参数设置,图5描述了在SC中进行IVPT试验的一个典型的试验参数设置[9]。该试验设计基本符合FDA《DraftGuidanceonAcyclovir》中的要求,例如每组供体数量大于4个、每个供体重复数大于4个、试验期间需要设置至少8个采样时间点、单次给药且给药量在5-15mg/cm²等。对于BE试验参数的选择,需要在关键试验前对试验方法进行开发和验证。
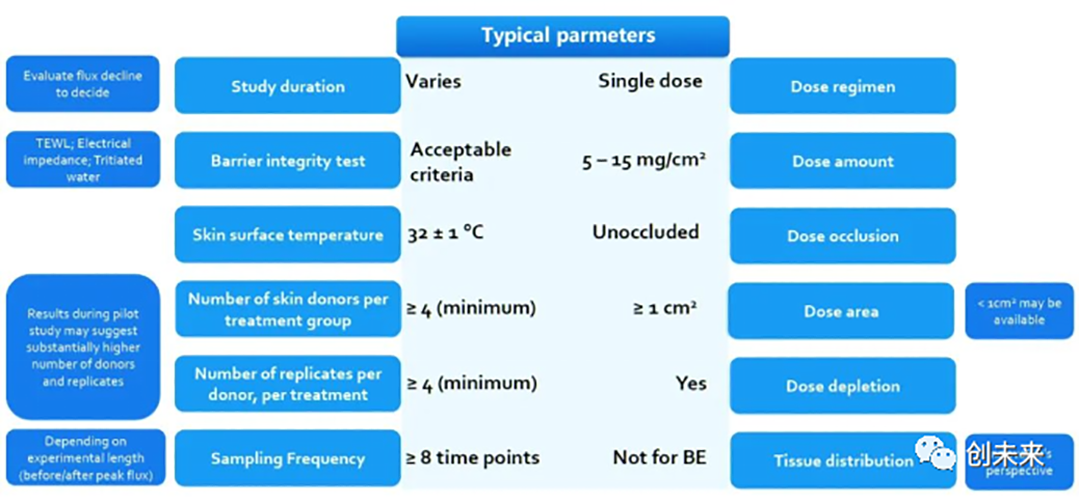
图3.IVPT试验设计中的参数设置[9]
示例
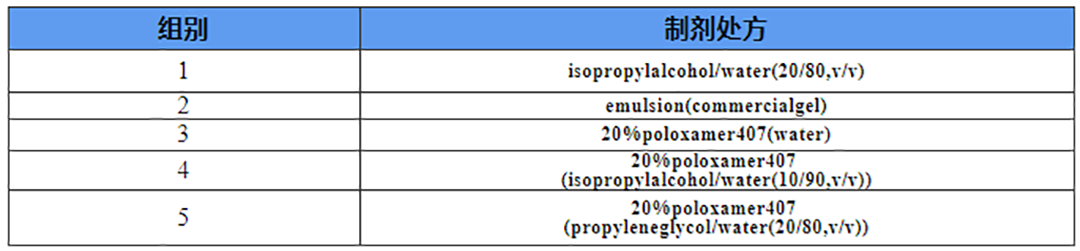
化合物A是一种应用广泛的非甾体抗炎药,系统给药后吸收和清除非常迅速,半衰期短。以化合物A为模型的药物,通过使用巴马小型猪背部皮肤在垂直Franz扩散系统(PermeGear,Inc.)上评估6种不同制剂条件下药物的体外透皮过程,为进一步的处方优化提供依据。试验中,第1组为澄清溶液制剂,第2组为商品化的凝胶制剂,第3、4、5、6组为自主筛选的泊洛沙姆制剂。
表4.各组制剂处方
试验过程
●试验前,选取巴马小型猪背部皮肤,并将皮肤厚度定量至750μm。将处理好的皮肤角质层朝上置于供体室和受体室之间,并筛选经表皮水分丢失量合格的皮肤用于试验。单次给药1.16%w/w的化合物A制剂。
●在试验期间,模拟正常皮肤温度条件,皮肤温度保持在32±1°C。在预定的时间点从接收室采集接收液(200μL)。
●试验结束后,清洗并剥离角质层,收集表皮和真皮以测定化合物在皮肤中的分布。试验结果如图4、图5所示。
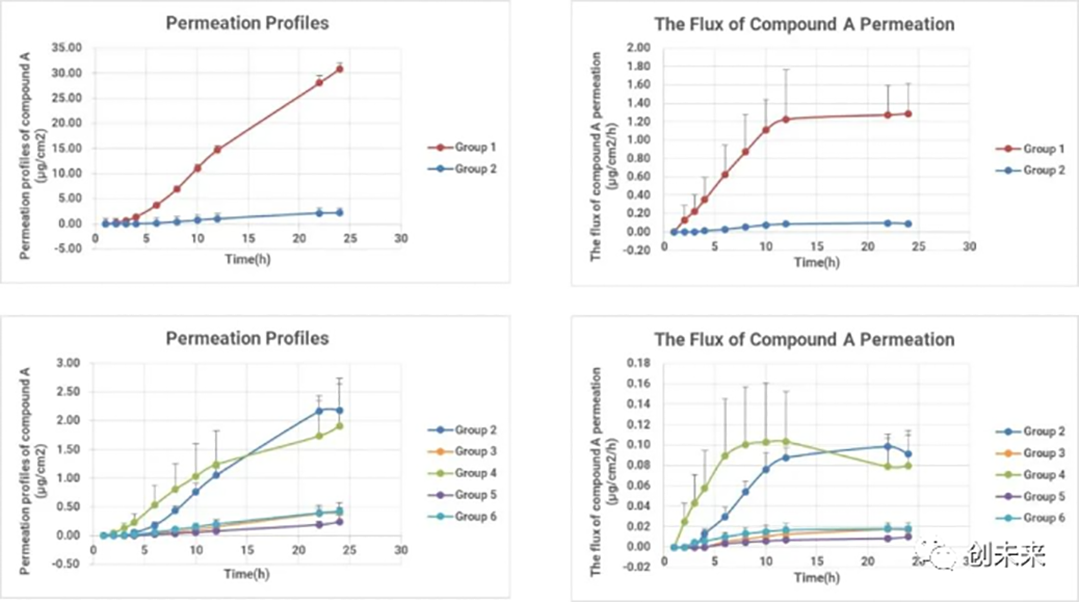
图4.各组制剂的累积渗透量(左)及渗透速率(右)随时间变化图
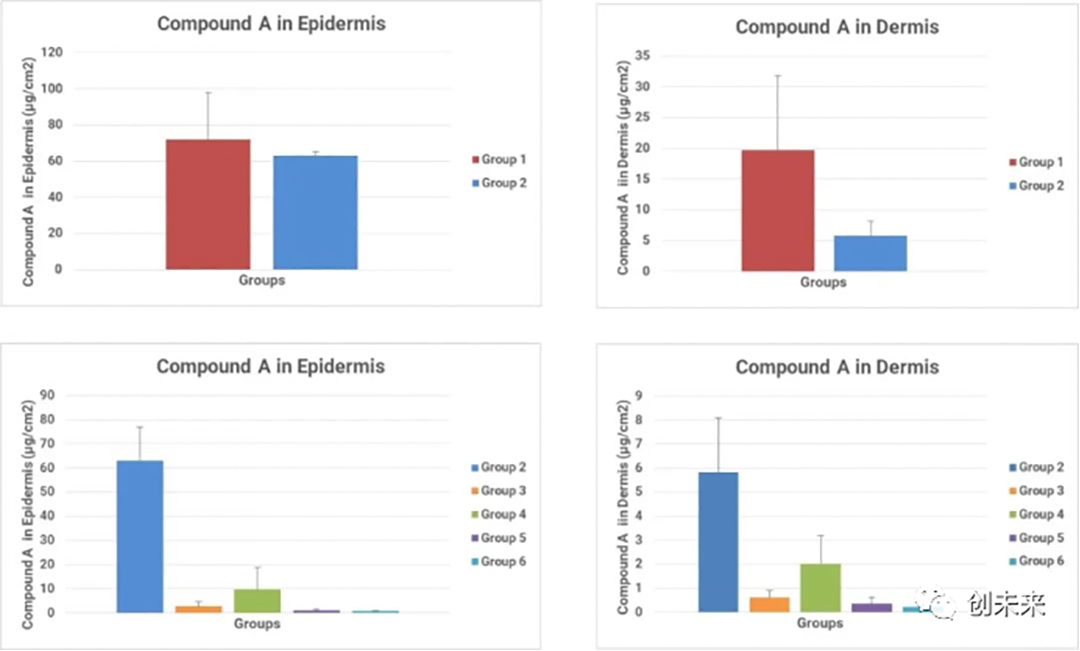
图5.给药后24h,化合物A在表皮(左)和真皮(右)中的滞留量
图5的结果显示垂直Franz扩散系统对不同制剂的经皮渗透特点具有很好的区分度,例如相比于第1组的澄清溶液制剂,第2组商品化的凝胶制剂显著降低了药物的渗透速率和渗透量。
对于4种泊洛沙姆制剂,不同溶媒的配比均改变了药物的透皮特性,为后续制剂筛选优化打下了坚实的基础。图7显示了给药后24h,各组制剂中化合物A在表皮和真皮皮内的滞留量。含有泊洛沙姆的制剂组(第3-6组)中,化合物A的表皮和真皮皮内滞留量显著降低。
小结
开发高质量的透皮剂型仍然颇具挑战性。药物的经皮吸收是一个多因素多步骤的过程,体外经皮渗透的结果也受多种因素影响,包括动物来源、皮肤类型、皮肤预处理步骤、待测化合物的理化性质和递送系统等。
参考文献
[1]LayersoftheSkin(https://courses.lumenlearning.com/suny-wmopen-biology2/chapter/structure-and-function-of-skin/)[Z].
[2] NMPA.皮肤外用化学仿制药研究技术指导原则(试行)[S].2021.
[3] FDA.DraftGuidanceonAcyclovir[S].2016.
[4]EMA.CHMP:Draftguidelineonqualityandequivalenceoftopicalproducts[S].2018.
[5] PMDA.局所皮膚適用製剤(半固形製剤及び貼付剤)の処方変更のための生物学的同等性試験ガイドラインについて[S].2010.
[6]TODOH.TransdermalPermeationofDrugsinVariousAnimalSpecies[J].Pharmaceutics,2017,9(3).
[7]MANGELSDORFS,VERGOUT,STERRYW,etal.Comparativestudyofhairfolliclemorphologyineightmammalianspeciesandhumans[J].SkinResTechnol,2014,20(2):147-154.
[8]BRONAUGHRL,STEWARTRF,CONGDONER.Methodsforinvitropercutaneousabsorptionstudies.II.Animalmodelsforhumanskin[J].ToxicolApplPharmacol,1982,62(3):481-488.[9]SANTOSLL,SWOFFORDNJ,SANTIAGOBG.InVitroPermeationTest(IVPT)forPharmacokineticAssessmentofTopicalDermatologicalFormulations[J].CurrProtocPharmacol,2020,91(1):e79.
本网站刊载的各类文章重在分享,尊重原创,如有侵权请联系我们(it@haigetang.com),我们将会在第一时间之内删除。



