与局部作用的贴剂( topic patch) 不同,透皮贴剂( transdermal patch) 是指用于完整皮肤表面,药物透过皮肤由毛细血管吸收进入全身血液循环并达到有效血药浓度,全身起作用的一类特殊制剂[1],是目前透皮给药系统( TDDS) 中应用最广泛的一种制剂。透皮贴剂能避免肝脏首过作用及胃肠因素的干扰; 能通过控制递送速率实现预定时长内持续的药物释放; 可用于睡眠、昏迷状态下无法吞咽的患者,并可根据需要随时移除。因其独特的剂型优势已成为全球研发热点。
随着大量专利产品面临到期,国内厂家对于该剂型的仿制热度骤增。2020 年12月,我国药品监督管理部门公布了《化学仿制药透皮贴剂药学研究技术指导原则》,对当前国内透皮贴剂类仿制药在药物开发、工艺研发以及质量研究、稳定性研究等环节的一些通用和特性要求进行了阐述和明确[2],但对关键的体内生物等效性( BE) 研究,国内尚无指南参考。透皮贴剂的BE 研究在整体设计、剂量选择、评价指标、试验流程、统计分析等环节均有其特殊性。本文将对透皮贴剂目前的国内外研究现状、透皮贴剂BE 研究面临的挑战进行分析,综合国外先进监管机构的指南及相关文献,对如何开展透皮贴剂的BE 研究进行系统阐述,为国内申请人从事相关研究提供参考。
透皮贴剂的国内外研究现状
自1979 年首个透皮贴剂( 东莨菪碱) 成功上市后,目前全球已有20 余种化合物的透皮贴剂开发成功。国内外透皮制剂的适应证主要集中在疼痛、呕吐、哮喘、高血压、阿尔茨海默病、成瘾戒断、避孕及激素替代治疗等领域。由于人口老龄化以及慢性病患者对于更简单便捷给药方式需求的增加,透皮贴剂具有广阔的市场前景。原研产品的专利到期后,开发高质量、安全、有效的仿制药能使更多患者受益。我国药品监督管理部门公布的仿制药参比制剂目录中已收载了多种透皮贴剂: 利斯的明透皮贴剂( Novartis Europharm Limited,第22 批目录) 、丁丙诺啡透皮贴剂( Mundipharma GmbH,第24,26 批目录) 、妥洛特罗透皮贴剂( 日东电工株式会社,第26,28 批目录) 。目前国内已有多家企业正在开展透皮类仿制药的相关研究,但透皮贴剂的处方组成和制备工艺相对复杂,体内一致性评价常面临较大的挑战。
内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明来源于凡默谷公众号。
透皮贴剂生物等效性研究的挑战及注意事项
透皮贴剂的规格表述
目前对透皮贴剂规格没有明确的统一要求,有载药量、载药量/贴剂面积、释药速率等多种表述方式。透皮贴剂一般通过扩散而起作用,为保证在使用期间达到预期的释药速率,其载药量往往大于进入人体的药量。各国监管部门鼓励开发更小载药量和更小贴片面积的仿制药,以降低使用后贴片中残留活性物质的危害。因此,仿制药与参比制剂相比,载药量和贴剂面积可不同,但仿制药与参比制剂在单位时间释放的活性物质的量即释药速率应该相同。规格表述不一给仿制药的研究及监管带来一定困扰,如: 不同的进口原研品种国内规格标示混乱; 如果要仿制这些进口原研制剂,按照仿制药要与参比制剂规格一致的要求将增加不必要的技术障碍; 对于我国已有仿制药的品种,在开展一致性评价时,可能无法找到合适的参比制剂。此外释药速率可源自药动学( PK) 研究数据或贴片残留药物分析,不同方法计算出的释药速率有可能会存在差异[3]。在进行仿制药研发时需了解原研药物的规格数据来源,保证仿制药( T) 与参比药( R)在相同时间内递送的剂量相同,并最终通过体内PK研究来证实。
影响透皮贴剂吸收的因素
透皮贴剂中药物通过皮肤吸收是一个复杂的途径,包括通过表皮、真皮的渗透和/或通过汗腺、皮腺、毛囊等皮肤附属物吸收。该过程除了与透皮贴剂本身有关外,还与受试者的年龄、性别、皮肤部位、皮肤厚度、汗腺功能、角质层完整程度等生理因素及环境的温湿度、光照程度及黏附力等多种因素有关[4]。试验中需注意受试贴剂、参比贴剂要在解剖学上对称的皮肤部位用药,两周期环境温湿度及受试者活动量保持一致,以减少生理因素及环境因素对BE 评价的影响。
黏附性研究的重要性
透皮贴剂通常由背衬层、活性层、接触式胶黏剂以及在使用前移除的保护层组成。根据活性层的结构特点分为骨架型和储库型,无论哪种类型,若不能保持在皮肤均匀附着,如出现边缘卷起甚至脱离皮肤时,透皮贴剂与皮肤接触的表面积以及潜在的药物输送量都会减少,体内PK 行为会随之发生改变。Wokovich 等[5]汇总了美国FDA 收到的因缺乏黏附力而影响贴剂安全性和有效性的多个案例。Miyazaki 等[6]对日本上市的10种活性药物成分( API) 的38 种透皮贴剂的黏附性能进行了考查,发现即使是相同的API、剂量和尺寸的贴剂,不同厂家生产的贴剂黏附性能也存在很大的差异。这给仿制药与原研药的BE 研究带来了很大的不确定性。在贴剂BE 研究中,黏附力的考查应贯穿整个用药过程。
皮肤刺激性与致敏性研究的重要性
透皮贴剂中的药物成分和辅料成分( 促渗剂、赋形剂、胶黏剂、膜溶剂等) 可能会改变生理皮肤pH 值、破坏皮肤的角质层屏障、阻塞毛孔、导致给药部位细菌繁殖、作为致敏源产生免疫反应等,使患者出现刺激性和过敏性接触性皮炎。皮肤状况可能影响药物从透皮系统的吸收,严重的皮肤刺激还可能影响产品的功效和安全性[7 - 8]。在评价仿制药与原研药一致性时有必要对皮肤刺激性与致敏性( irratation and sensitization,I /S) 进行考查。研究者通过贴剂使用部位及周围的皮肤外观状态来评估刺激性与致敏性的大小,通常采用量表分级的方式来进行评估,存在一定主观性。应注意采取研究者统一培训、研究者盲法等措施来保证在周期间、个体间、制剂间评估标准的统一,并注意照片等原始资料的保存。
贴片残留药物的隐患
为了保持相对稳定的药物释放速率,透皮贴剂产品通常含有相对于给药剂量的过量药物,导致在产品使用后的贴片中残留大量药物。目前市场上销售的TDDS 在预期使用期后可能残留初始药物总量的10% ~ 95%[9 - 10]。使用后残留药物会带来一定的安全隐患,特别对于芬太尼等有一定成瘾性的药物,贴片产品中的过量残留药物增加了药物滥用的可能性[11]。在贴剂类仿制药一致性评价中,有必要对使用后贴片上的残留药物量进行分析。
体内体外相关性研究( IVIVC) 的难度
IVIVC研究已越来越多地应用在口服缓释制剂( ER) 药物的研发中,通过体外溶出曲线特征预测ER 产品的生物利用度[12]。因药物透过皮肤的机制复杂,虽然目前学术界与工业界致力于透皮制剂的IVIVC方法的开发,如采用Franz 细胞渗透研究、体外皮肤渗透性研究等预测体内PK 行为,但透皮制剂的IVIVC 方法仍有待完善,目前仅限于作为评估透皮候选药物的皮肤渗透性和优化处方性能的工具,监管部门尚未将其用于支持透皮制剂的体内BE豁免。
透皮贴剂生物等效性研究的设计与实施要点
目前国际上只有欧洲EMA 和美国FDA 出台了透皮贴剂仿制药体内一致性评价的相关指南,EMA和FDA 指南的总体要求基本一致[13 - 17],除了以PK参数为评价指标的BE 研究外,还需进行黏附力研究、皮肤I /S 研究,但在具体实施细则上有一定差别,如: 是否要求进行多剂量PK 研究、黏附力研究的统计方法、I /S 诱导期的给药频次、I /S 评分量表等,EMA 与FDA 要求不完全相同,FDA 与EMA 指南的对比情况见表1。


以下结合FDA 指南及已发表的文献,详细介绍透皮贴剂BE 研究的设计与实施要点。
整体设计
透皮贴剂的体内一致性评价通常包括PK 研究、黏附力研究、I /S 研究。黏附力研究可在PK 研究的同时进行考查,也可以单独考查。PK 研究与黏附力研究通常采用两周期两序列( TR,RT) 的设计,两周期外用于解剖学上对称的位置,有研究者为减小给药部位左右用药顺序对试验结果的影响,采用改良两周期设计[18],受试者随机分为4个给药序列组( T right→R left,T left→R right,R right→T left,R left→T right) 。I /S 研究通常采用联合设计,采用多中心、评估者盲法、受试者内重复、给药部位随机的试验设计,分为诱导/累积刺激期和激发期2 个阶段,2个阶段间有14 d 不用药的休息期。
受试者选择
受试者一般包括2 种性别( 说明书规定适应证人群为特定性别的药物除外) 的成年健康受试者,人群需具有一定代表性,如利斯的明透皮贴需纳入一定的老年受试者、雌二醇透皮贴剂以绝经后的妇女为受试者、睾酮透皮贴剂以性腺功能减退的成年男性为受试者。在排除标准中需根据API 的药理特点排除一些有潜在安全性风险的人群( 如奥昔布宁透皮贴剂作用于胆碱能受体,需排除有尿潴留、窄角型青光眼病史的受试者) ,还需根据剂型特点排除有皮肤病史者或已知可改变皮肤外观或生理反应病史者,身体拟用药的对称部位肤色有明显差异、应用部位有疤痕组织、纹身等影响皮肤状态评估的受试者也应排除。在受试者用药史的排查中重点关注对API 药动学有影响的药物和可能影响炎症或免疫反应的药物。受试者的筛选应有皮肤科专家或有相应资质的研究人员参与。
剂量选择
以PK 参数为终点指标的BE 研究及黏附力研究通常以参比制剂主要适应证的单片使用量进行研究,如果参比制剂存在多个规格,通常选择最高规格开展研究( 若不同规格间处方是成比的,其他规格贴剂通常可以豁免) 。I /S 研究采用个体内重复的试验设计,受试者需在连续给药周期内在身体对称部位同时应用T 和R,应在保证受试者安全的前提下选择合适的规格进行研究,如可乐定透皮贴剂在进行PK 和黏附力研究时采用0. 3 mg·h - 1的规格,而进行I /S 研究时采用0. 1 mg·h - 1 规格[19]。对于没有明确安全性信息确保能同时使用T 和R时,如: 格拉司琼、利斯的明、炔雌醇甲基孕酮、罗替戈汀等透皮贴剂,FDA 推荐在进行I /S 试验时,采用贴剂分割后应用1 /2 贴片的方法进行研究; 若出于安全考虑,不能对试验和参考产品进行直接比较研究,如丁丙诺啡、芬太尼、东莨菪碱等透皮贴剂,可采用弱刺激性阳性对照( 0. 1% 十二烷基硫酸钠) 来进行I /S 评价。
评价指标与样本量
以PK 参数为终点指标的BE 研究一般以Cmax, AUC0 - t, AUC0 - inf为评价指标。对于药效受吸收速度影响较为明显的哌醋甲酯透皮贴剂,还应增加给药后2 ~ 9 h 的截取药时曲线下面积( AUC2 - 9h) 作为评价指标,API 为内源性成分的应根据体内基线值对参数进行相应较正,如睾酮贴剂以用药前基线校正后的药动学参数作为评价指标; 雌二醇贴剂以基线校正前及校正后的药动学参数作为评价指标。为得到完整的药时曲线,从而准确计算药动学参数,药品移除后需采样至3 ~ 5 个半衰期。清洗期至少4 ~ 6 个半衰期,清洗期以第1 周期贴片移除开始计算。贴片移除后需妥善回收,进行残留量的测定。
黏附力研究以黏附面积百分比或黏附力评分为评价指标。在两周期用药后不同时间点观察贴剂与皮肤的黏附情况,通常采用等时间距评估,如12 h贴片每隔1 h 评估1 次; 24 h 贴片每隔4 h 评估1次; 72 h 贴片每隔12 h 评估1 次; 7 d 贴片每隔24 h评估1 次。由经过统一培训的研究者在盲态下进行观察,根据每个时间点贴片的实际附着状态独立评价,无论该分数相对于前一个时间点增加或是减少。每个观察点需以拍照的方式记录下贴片在皮肤上的黏附状态,可采用与贴片面积相同的10 × 10 的透明点矩标尺来辅助评估,还需记录试验中贴剂是否出现褶皱、位移,或移除贴剂后给药部位是否留下压敏胶残留等现象,照片作为黏附力结果的原始证据留存。I /S 联合试验的3 阶段研究流程见图1。
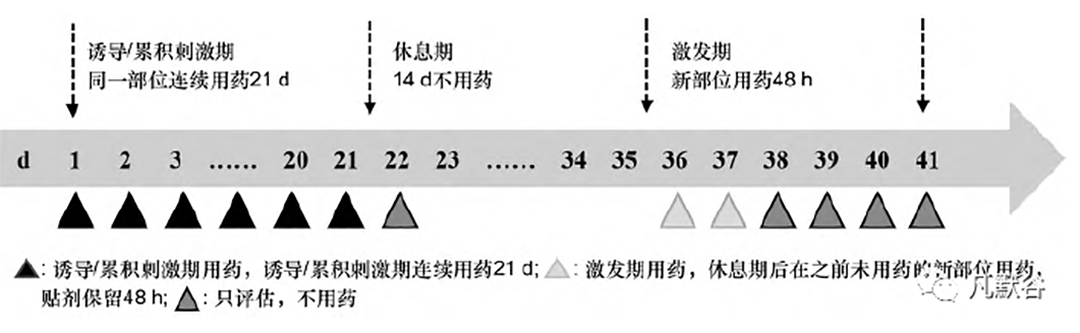
诱导/累积刺激阶段受试者连续21 d 使用T,R 和安慰剂透皮贴,每种贴剂的应用部位根据随机号分配,每次移除旧贴剂时,研究者需在盲态下对给药部位进行皮肤刺激评估( 确定皮肤反应和其他效应评分,FDA 评分量表见表2) ,然后在首次使用的相同部位重复使用相应试验药物。

经过14 d 的休息期,激发期在之前未用药的新部位应用系列试验药物,并保留48 h,在激发期移除贴剂后的0. 5, 24, 48,72 h 对给药部位进行评估。FDA 推荐以皮肤反应评分和其他效应评分之和作为联合评价指标进行I /S 评估。每个评估时间点的皮肤状况均要拍照,照片作为I /S 研究结果的原始证据留存。
样本量根据统计学原理来进行计算,并考虑一定的脱落风险预先设定。生物等效性研究与黏附力研究如果在一个研究中同时开展的话,需适当增加样本量,以保证PK 终点与黏附力终点2 个独立的观察指标均有足够的把握度。I /S 研究纳入统计的例数通常不少于200 例,可采用多中心研究。
给药
应根据R 药说明书确定用药部位,T 和R 应用于解剖学对称的皮肤部位。给药前保证给药部位皮肤清洁干燥,多余的毛发需进行修剪( 而不是剃掉) ,不能涂沫护肤品、酒精等。在芬太尼、丁丙诺啡等阿片类的镇痛贴使用前受试者应服用阿片拮抗剂( 如盐酸纳曲酮) 减少不良反应。给药时统一按压时长,确保敷贴完整。在用药时限内避免受试者的给药部位暴露于加热垫、电热毯和/或长时间的阳光直射,试验期间受试者不应进行游泳、桑拿,但通常不限制受试者正常的活动( 如进行短时间的淋浴和穿脱衣物等) ,尽量保证两周期的活动相同。在以PK 参数为评价指标的BE 研究及黏附力研究中,需避免受试者有意对贴剂施加压力或其他加强皮肤附着力的行为。I /S 研究一般在最大应激条件下比较T 和R 引起刺激和/或敏化反应的可能性,I /S 研究中可根据需要使用胶带或覆盖层来保持贴剂与皮肤的最大接触。
数据管理与统计方法
透皮贴剂仿制药需从PK、黏附力、I /S 几方面与原研药进行全面比较。根据不同的目的,纳入分析的受试者要求以及数据统计方法有所不同,在试验方案中需对各统计分析集的划分标准及统计方法事先作出规定。
在以PK 为评价指标的BE 研究中,药动学浓度集( PKCS) 包括所有随机化,且接受过至少1 次研究药物,并有至少1 个用药后有效的检测成分浓度数据的受试者。原则上所有已采集的生物样本均需要进行检测,即使是有受试者出现黏附力的问题或因刺激性而提前终止给药。药动学参数集( PKPS) 包括接受过至少1 次研究药物的受试者中获得的药动学参数数据集。生物等效性集( BES) 通常包括至少1 个周期且具有至少1 个可评价药动学参数的统计分析集。用药期间因非黏附力问题而提前移除贴剂者,该周期的药动学参数通常不纳入BES 统计,而对因黏附力问题未能在用药时限内保持贴剂完整贴覆的受试者是否纳入统计需在方案中事先作出规定( 如将贴剂移除前的黏附力评分> 2 的受试者,该周期药动学参数剔除BES[17]) 。统计方法为基于BES计算T 和R 药动学参数几何均数比的90% 置信区间( 90%CI) 是否在80% ~ 125%等效范围内。因黏附力问题被剔除BES 的药动学数据仍需列表提交,并进行敏感性分析。
黏附力研究中,符合方案集( PPS) 包括在规定的用药时限内完成黏附力观察的受试者,对T 和R要分别定义PPS。用药期间因刺激性或其他与黏附力无关的问题,如方案违背等导致贴剂提前移除的受试者需被剔除,但因黏附力问题导致贴剂脱落者应根据末次结转( LOCF) 原则,在当前及后续的观察时间点按最高的黏附力评分( 完全脱落) 进行计算。数据统计时先分别计算每名受试者T 和R 用药后的个体平均黏附力评分:
观察时间点等矩分布时计算公式为:

观察时间点非等矩时计算公式为:
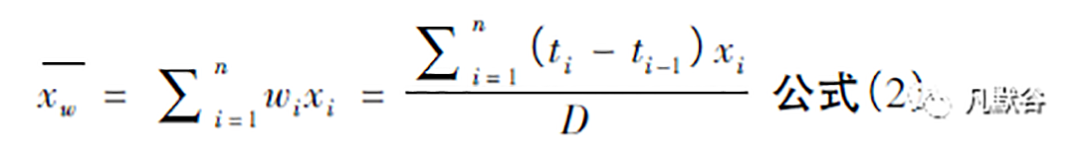
其中n 为给药后的黏附力观察时间点数,wi为权重系数( 在观察时间点非等矩时根据前后2 个观察时间的间矩占整个用药时长的比例来进行加权,ti为给药后第i 个观察点的时间,D 为整个用药时长) ,x i为根据LOCF 原则结转后的受试者给药后第i 个观察时间点的黏附力评分( 研究者在各时间点对黏附力的观察是在盲态下独立评估的,可能因测量误差出现xi < xi - 1的情况,应采用前一时段高分值向下一时段结转的LOCF 原则,保证最终代入运算时xi ≥ xi - 1) 。然后基于PPS 计算T 和R 的群体平均黏附评分差值进行NI 分析( δ = 0. 15) 。
FDA经过模拟认为采用基于均值差( difference-of-means,DOM) 的NI 检验比传统的基于均值比( ratio-ofmeans,ROM) 的NI 检验对黏附力的检测更有效,能显著减少样本量[20 - 21]。此外,还有通过计算T 药移除药物前黏附面积百分比90% CI[14]; 对T 和R 黏附力等级进行非参数检验[22]等其他方法来评价仿制贴剂的黏附性能。
累积刺激研究中,PPS 包括完成了在同一部位连续用药21 d 的受试者,分别对3 种贴剂( T,R 和安慰剂) 定义PPS。在用药期间完全脱落超过24 h的受试者被剔除,但因过度刺激被移动或移除者需采用LOCF 原则对刺激性评分进行结转。统计方法是基于PPS 计算T 和R 的群体平均刺激性评分采用NI 分析( δ = 0. 20) 。
致敏性研究中,PPS 包括完成了诱导期与激发期用药,且在用药期间完全脱落不超过24 h 并有激发期皮肤评估数据的受试者。如果贴剂是由于过度刺激而被移动或移除应采用LOCF 原则进行数据结转。在激发期移除贴剂后48 和72 h 综合刺激评分≥2 的受试者,应评估其潜在的致敏作用,对激发期每种反应进行描述性分析,结合激发期反应出现的时间以及与诱导期反应程度的比较等,判断这些反应是否有接触性过敏反应的指征。
讨论
透皮贴剂仿制药与原研药在辅料、工艺上的微小差别有导致两者安全性、有效性差异的潜在风险,如何评价透皮贴剂仿制药的体内一致性,FDA 与EMA 已出台相关指南,构建了总体的评价框架。但FDA 与EMA 的指南的评价细则上有一定差异,对于I /S 研究中累积刺激试验采用同一部位反复用药而产生伦理问题,学术界亦有争议[23]。国内申办者、研究者、审评专家需对这些分歧问题进行理论和实践的研究。在此基础上,国内监管部门应尽快出台相关技术指导原则。
参考文献
详见 《中国新药杂志》2021 年第30 卷第24期
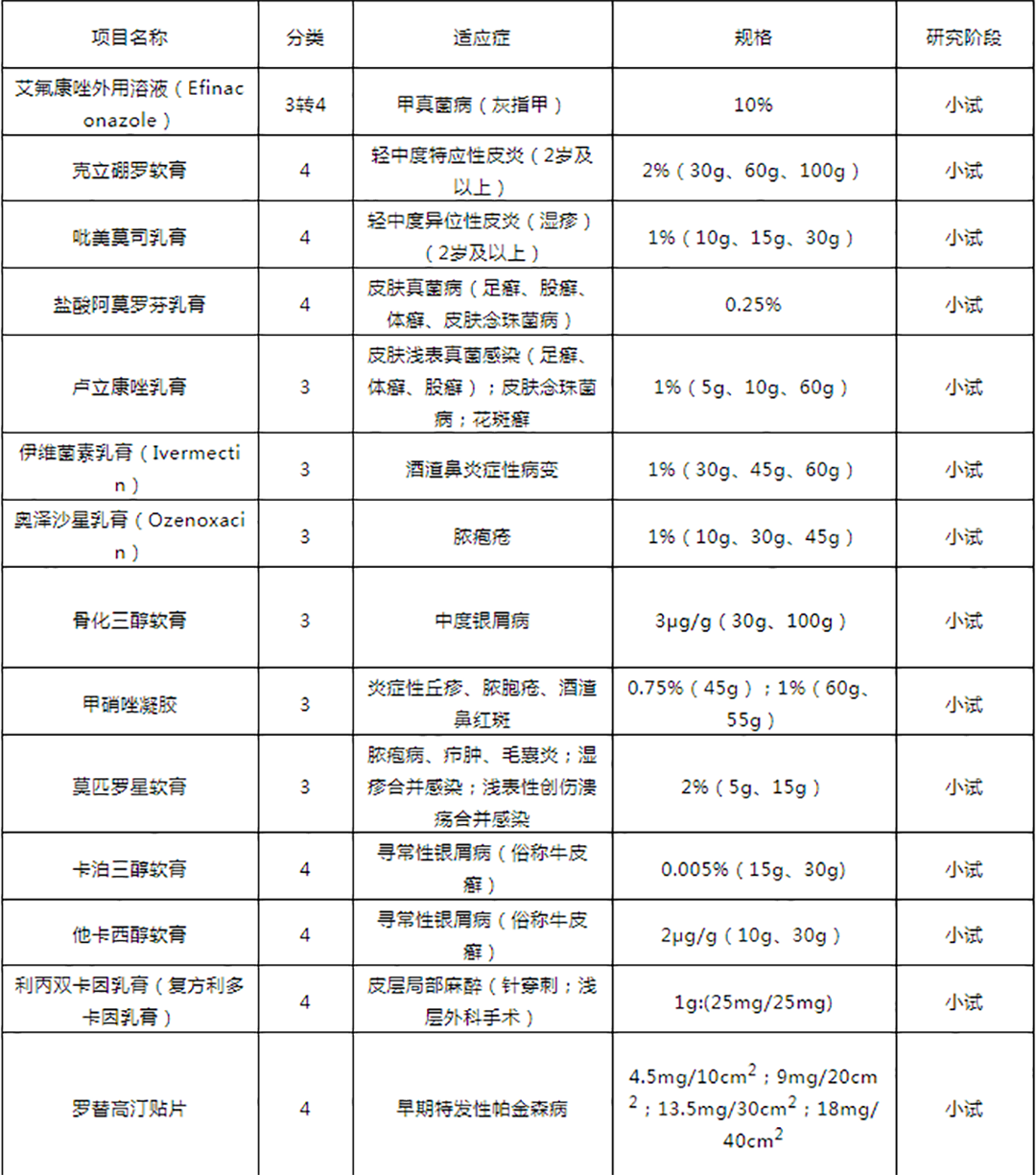
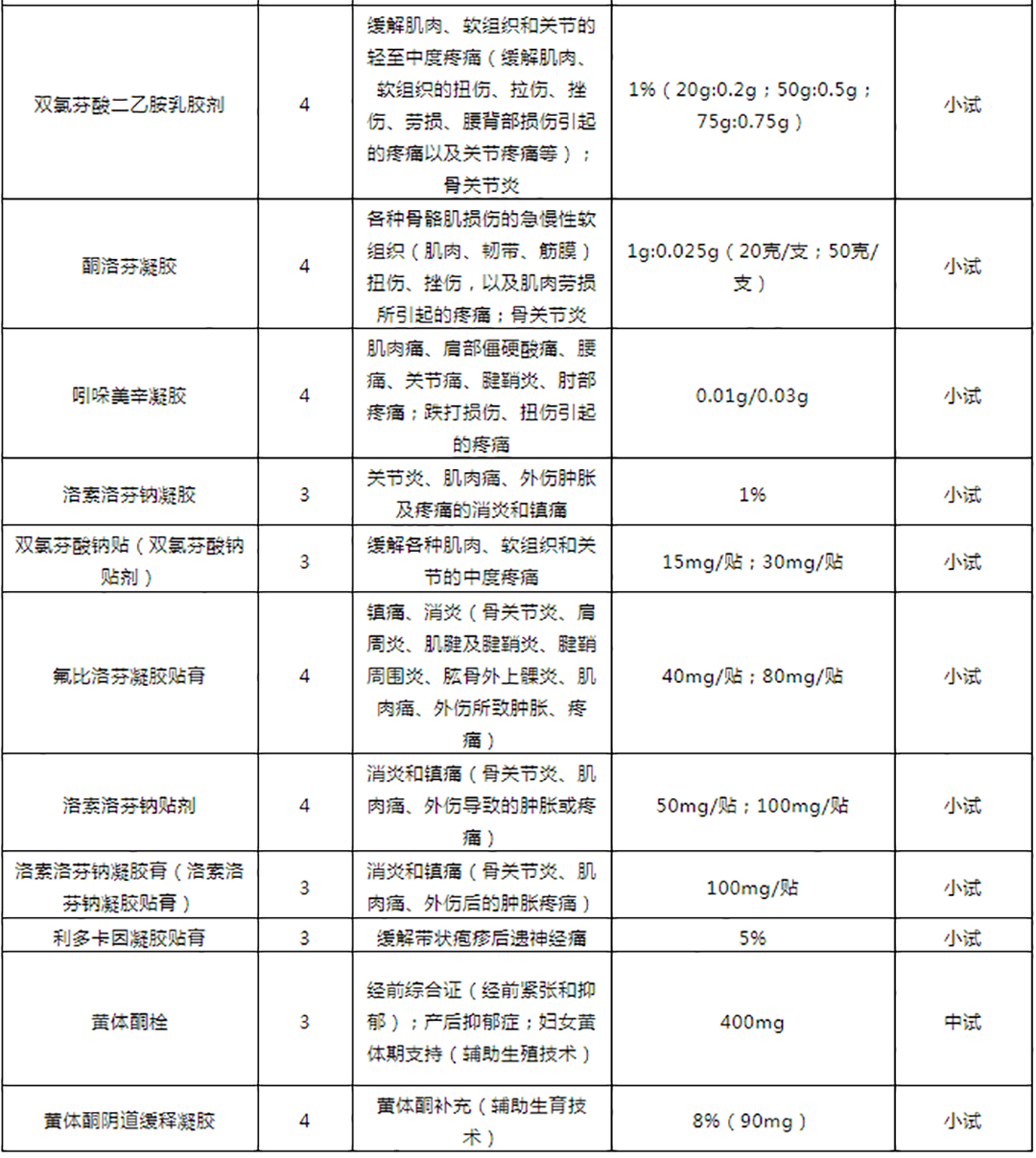
皮肤外用制剂立项推荐
项目转让 / 委托开发
来源:
作者:
皖南医学院弋矶山医院药物评价中心
内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明来源于凡默谷公众号。
本网站刊载的各类文章重在分享,尊重原创,如有侵权请联系我们(it@haigetang.com),我们将会在第一时间之内删除。



