
摘要:透皮给药系统(TDDS)是一种有前景、备受青睐且普及的新型给药方式。它具有给药方便、易于处理、最小化全身暴露、减少不适、广泛的灵活性和可调性、控制释放以及延长疗效等优势,这些特点使其成为一种高效的药物输送手段。然而,主要的挑战在于皮肤渗透性不佳。皮肤是一个完整的屏障,其主要功能是防止外来物质进入体内。由于其独特的解剖结构,包括紧密堆积的角质层、紧密的连接和快速的抗炎反应,这些特性构成了 TDDS 的主要生理障碍。通过结合纳米载体、定制的透皮给药设备、渗透增强剂等创新方法,可以克服这些限制。目前,一些产品已进入临床试验阶段。本综述旨在探讨如何克服渗透性差的问题,以最大限度地发挥药物的潜力。文章首先概述了 TDDS 的基本特性、组成和设计,然后深入探讨了关键方面和各种方法,包括用于评估皮肤渗透性的体外、离体和体内方法。本研究的主要目标是强调使用离子电渗疗法、电穿孔、声波透入法、微针、无针喷射注射等主动方法,以及脂质体、固体脂质纳米粒(SLN)、纳米结构脂质载体(NLC)、微/纳米乳液、树枝状聚合物、传递体等被动方法进行有效透皮给药的最新进展。总的来说,本文提供了关于这些新策略的最新见解,以及基本概念、临床开发的现状和 TDDS 临床转化的挑战。
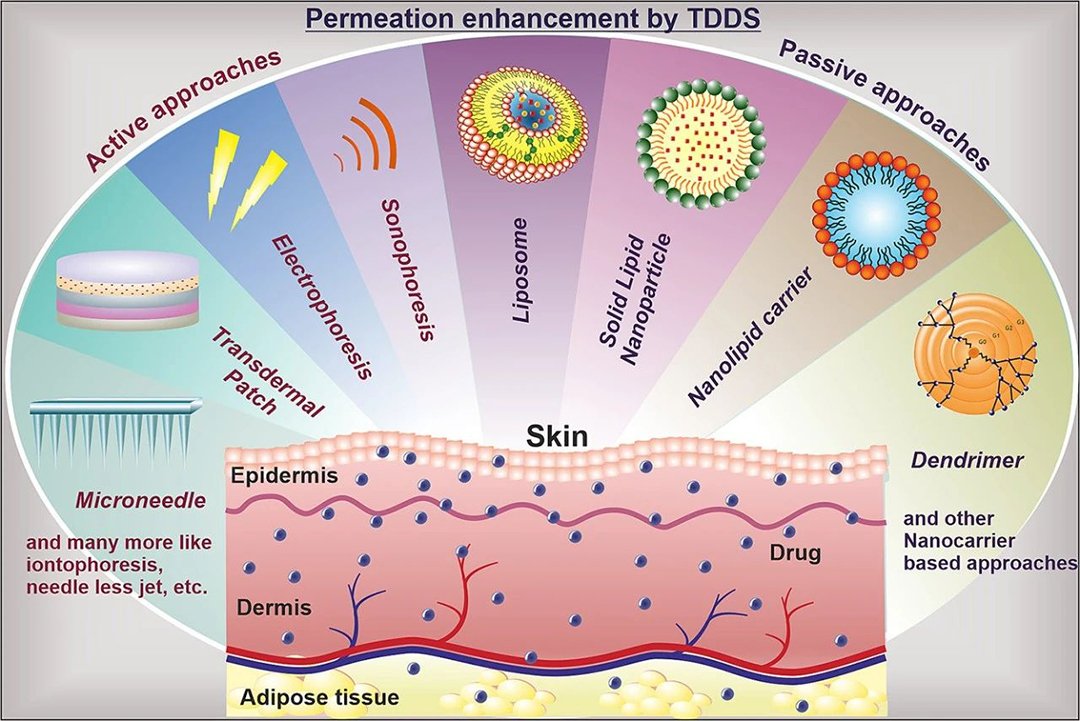
引言
透皮给药系统(TDDS)允许药物分子穿透皮肤屏障,进而进入体循环。这种方法提供了一种无痛的全身给药途径。与局部给药系统相比,TDDS 能够以一种预定且可控的速率,将药物输送至体循环。作为一种替代口服和注射给药系统的有希望的选择,TDDS 通过减少和消除其固有的缺陷来提供优势。口服和注射给药系统存在局限性,例如血浆药物水平的波动,可能导致不可预测和不稳定的治疗效果。TDDS 通过持续的药物输送,有助于降低副作用的风险,同时确保药物水平保持在治疗所需的最小浓度以上。此外,作为一种受控的给药系统,TDDS 不仅方便和用户友好,而且在必要时可以轻松终止,且疼痛感较低。此外,TDDS 还避免了胃肠道的 pH 值和消化酶的影响,绕过了首过代谢,从而提高了药物的生物利用度。
TDDS的当前市场场景
透皮给药系统市场自 2005 年的 127 亿美元起,经历了显著的增长,至 2010 年达到 215 亿美元,并在 2018 年进一步攀升至 377.9 亿美元。预计到 2024 年,这一数字将增至约 493.7 亿美元。根据 2021 年的数据,全球透皮给药市场的估值为 551.0033 亿美元,展望 2030 年,市场规模有望扩展至 884.2240 亿美元,届时的复合年增长率(CAGR)预计将为5.0%。新型冠状病毒(COVID-19)的全球传播对全球各地的民众生活造成了深远的影响。尽管如此,COVID-19 疫苗的快速研发不仅促进了市场的重新开放,而且通过全面的科研活动,为市场复苏提供了动力。市场按地区划分为北美、亚太、欧洲和LAMEA(拉丁美洲和中东非洲)。特别地,北美地区在 2020 年占据了透皮给药系统市场的最大份额。透皮产品的使用率不断上升,凸显了透皮给药系统在医疗保健领域的核心地位。
TDDS 的阻碍的洞察
为了实现有效的经皮药物递送系统(TDDS),药物必须穿透皮肤屏障并达到预定目标。皮肤作为人体最大的器官,其表面积达到 2 平方米,约占体重的 15%,提供了一个容易接近的途径。它不仅作为物理屏障,保护我们免受外界环境的侵害,同时也维持着身体的内部平衡。值得注意的是,皮肤还参与了约三分之一的血液循环,这使得它成为药物递送的一个关键途径。
皮肤结构由三个主要层次构成:表皮、真皮和皮下组织。表皮本身由两层组成,即非活表皮(角质层)和活表皮(包括透明层、颗粒层、棘层和基底层)。角质层作为非活表皮,是大多数药物渗透的主要障碍。其屏障功能主要得益于亲水性角蛋白的有序排列,以及它们周围紧密的疏水性脂质层。表皮的厚度在不同身体部位变化,大约在0.5至1.0毫米之间。角质层的主要成分包括神经酰胺(50%)、胆固醇(25%)和脂肪酸等,这些成分赋予了它疏水性。此外,角质层中还充满了密集的死角质细胞,这些细胞富含角蛋白。正是这些特性,使得角质层成为药物渗透皮肤的主要障碍。尽管如此,活性化合物仍然可以通过特定的机制穿过这些屏障,包括跨细胞渗透、细胞间渗透、通过毛囊的附属物渗透,以及通过皮脂腺或汗腺的渗透。此外,一些转运蛋白,如 P-糖蛋白,也协助大分子的吸收。活表皮作为皮肤渗透的第二个物理屏障,由紧密连接的粘附膜蛋白构成。
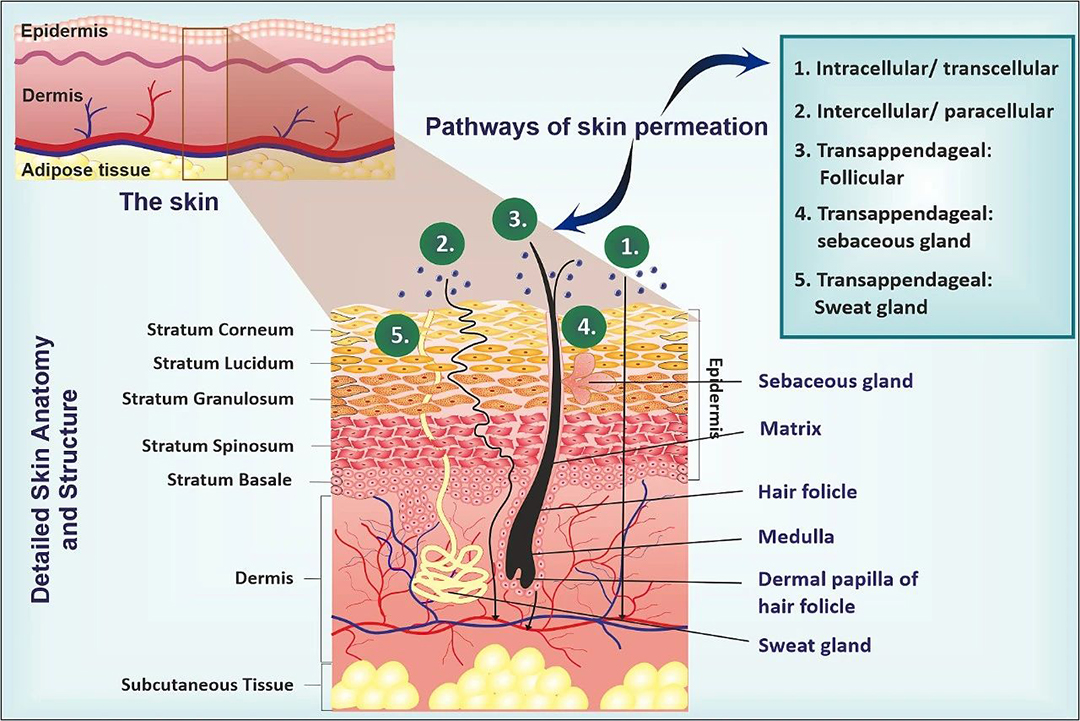
图1.皮肤解剖以及皮肤渗透途径,包括跨细胞、细胞旁和经附属器的。
真皮层不仅赋予皮肤弹性和韧性,而且其厚度在不同身体部位呈现显著差异。这种特性主要来源于其丰富的胶原蛋白(约占70%)和弹性纤维。真皮层还承担着通过淋巴管排除体内毒素的重要功能。而皮下组织作为皮肤的最底层,充当着皮肤与身体深层组织之间的桥梁,主要由脂肪细胞构成,这些脂肪细胞不仅起到保温和缓冲作用,还是神经和血管的通道。
细胞内脂质片层通过角质层的初始层相互结合,形成独特的脂质双层结构。这种结构的特殊性使得角质层的脂质含量与其他膜存在显著差异,从而影响其脂相行为。这种特性在一定程度上限制了药物向全身循环的传输。
皮肤的独特屏障功能对于大多数治疗剂和外来成分至关重要。为了实现有效的经皮递送,研究者们开发了多种创新方法,包括使用渗透增强剂、离子电渗疗法、微针、声波透入法、激光消融、热消融、磁泳、喷射注射器、电穿孔和纳米载体等,以提高药物的皮肤穿透性。
本文综述了 TDDS 的基本构成、类型、渗透评估技术、经皮递送的改善策略以及 TDDS 的最新研究进展。本综述旨在提供 TDDS 从实验室到临床应用的关键见解。
透皮贴剂的功能成分和类型
聚合物基质(polymer matrix)是透皮给药系统(TDDS)的骨架材料,对药物释放速率和稳定性起着关键作用。制备时,药物可以分散在固态或液态的聚合物基质中。在挑选聚合物基质时,需要综合考虑生物相容性、成本效益、制造简易性、稳定性和安全性。聚合物的分子量和化学结构应与药物相匹配,以确保药物的有效扩散。药物的释放特性,包括速率和程度,以及药物的稳定性,均与所选聚合物紧密相关。此外,除了储库外,TDDS 的所有其他组件均由聚合物构成,因此,选择适当的聚合物至关重要。聚合物的降解产物也应具备无毒性。表1 中列出了 TDDS 中常用的聚合物类型。
天然聚合物因其相容性、生物可降解性和化学改性能力而备受重视。例如,壳聚糖作为一种天然聚合物,其独特的结构特征使其在粘膜粘附性方面具有显著优势。与此同时,物理结构、最大保质期和可用性是合成聚合物在经皮药物递送系统(TDDS)中使用时需要考虑的关键因素。聚乳酸和聚乙交酯等生物可降解和生物可吸收的聚合物,能够降解成生物可接受的分子,这些分子可以进一步被代谢。聚羟基乙基甲基丙烯酸酯(聚HEMA)在水溶液中形成水凝胶,其控释行为已被广泛研究。
在经皮药物递送系统中,控释膜(rate controlling membrane)是另一个关键组成部分,可用于控制药物的释放速率,其厚度在 2~7mm 之间。该膜在储库型系统中发挥着至关重要的作用,在该储库型系统中,通过将药物夹在背衬层和控释膜之间,来确保药物以预定的速率持续释放。微孔、大孔和半渗透性是药物分子通过控释膜时需要考虑的理想特性。
背衬层(Backing membrance)在药物储存系统中起到支撑作用,防止药物释放。设计背衬层时,化学耐受性、高柔韧性、兼容性和高水蒸气透过率是选择材料的关键标准。聚乙烯、聚氨酯、聚氯乙烯等材料是常用的背衬层。保护层或离型膜(Release liners)作为主要包装材料,直接与药物渗透层接触,应具备化学惰性、耐水性和抑制药物渗透的特性。保护层由基底层和释放涂层组成,基底层可以是封闭的或非封闭的,释放涂层则由特氟龙和硅制成。渗透增强剂(Permeation enhancers)通过降低渗透屏障来促进药物通过皮肤输送,它们应具备无毒、无刺激性等特性,并根据来源、化学类别和特性进行分类。渗透增强剂通过溶解皮肤脂质或蛋白质或破坏角质层的细胞间结构来增加透皮药物吸收,可能会引起皮肤刺激。但是,目前还没有渗透增强剂能够显著提高胰岛素、肽、蛋白质等高分子生物活性物质的皮肤渗透率。
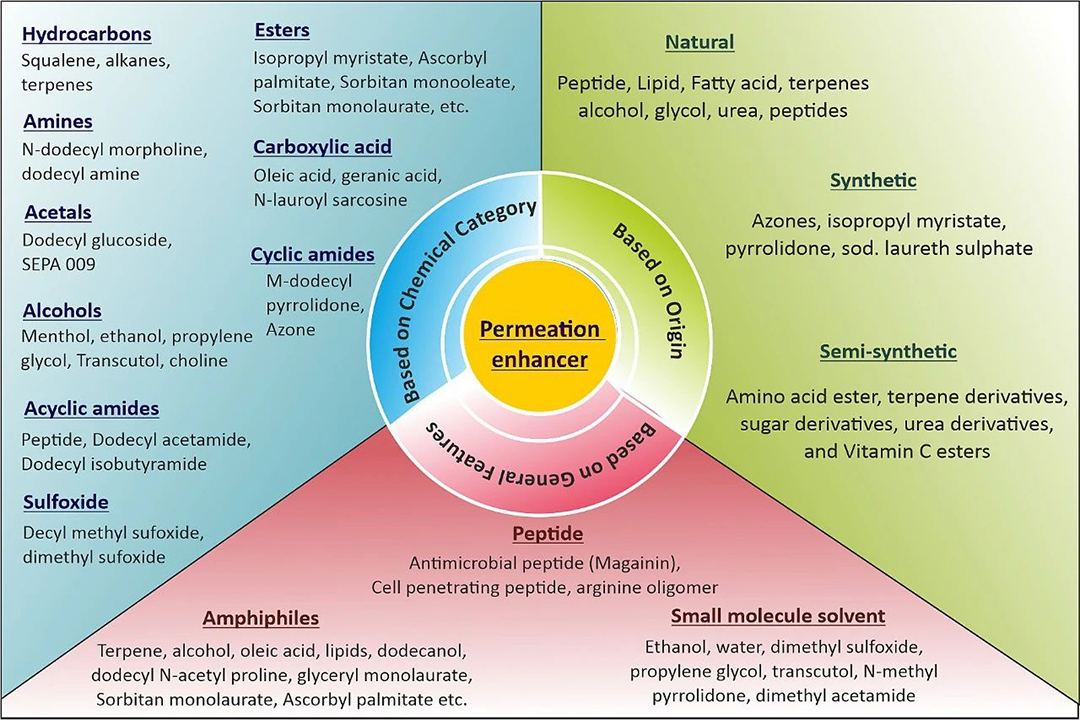
图2.根据化学类别、一般特征和来源对渗透增强剂进行分类。
药物的药代动力学、药理学以及物理化学特性是开发透皮给药系统(TDDS)的关键因素。高效(high potency)、低分子量、中等亲脂性和熔点低于250°C的活性分子是 TDDS 的理想候选者,因为这些特性与药物在皮肤角质层中的溶解度密切相关,从而影响非共价相互作用。近年来,活性药物成分离子液体(API-ILs)因其快速穿透膜的能力而在局部给药中受到青睐,尽管其临床应用仍处于早期阶段。
透皮贴剂根据其基本组成和制备方法的不同,可以分为储库型、黏胶分散型、聚合物骨架型和微储库型系统(见图3)。储库型系统(reservoir system)是一种将药物储库置于控释膜和背衬层之间的设计,如图3(a)所示。该系统通过控释膜调节药物从储库到皮肤的输送。药物可以以溶液、悬浮液或凝胶的形式分散在固体聚合物基质中。储库型系统的药物释放通常遵循零级动力学。Pichayakorn等人研究了一种用于尼古丁输送的储库型透皮贴剂,该贴剂通过热封技术将尼古丁储库嵌入特制的脱蛋白天然橡胶基控释膜和背衬层之间。该研究评估了脱蛋白天然橡胶乳胶作为控释膜的性能及其对药物渗透效率的影响。由于其良好的渗透性和稳定性,脱蛋白天然橡胶乳胶被认为是一种适合用于透皮贴剂的材料。另一项研究报道了使用柠檬烯作为渗透增强剂的蟾蜍灵透皮输送,乙酸乙烯酯作为控速膜,其中19%的乙烯基醋酸酯有助于药物释放。柠檬烯的添加显著提高了皮肤的渗透性,而卡波姆水凝胶则确保了蟾蜍灵从透皮贴剂中的持续释放。最近,液体储库型系统与纳米多孔微针阵列的结合,为美金刚胺的透皮输送提供了更精确的控制,这种结合方法被认为是一种先进的技术,用于输送高剂量的美金刚胺以实现更长时间的持续释放。
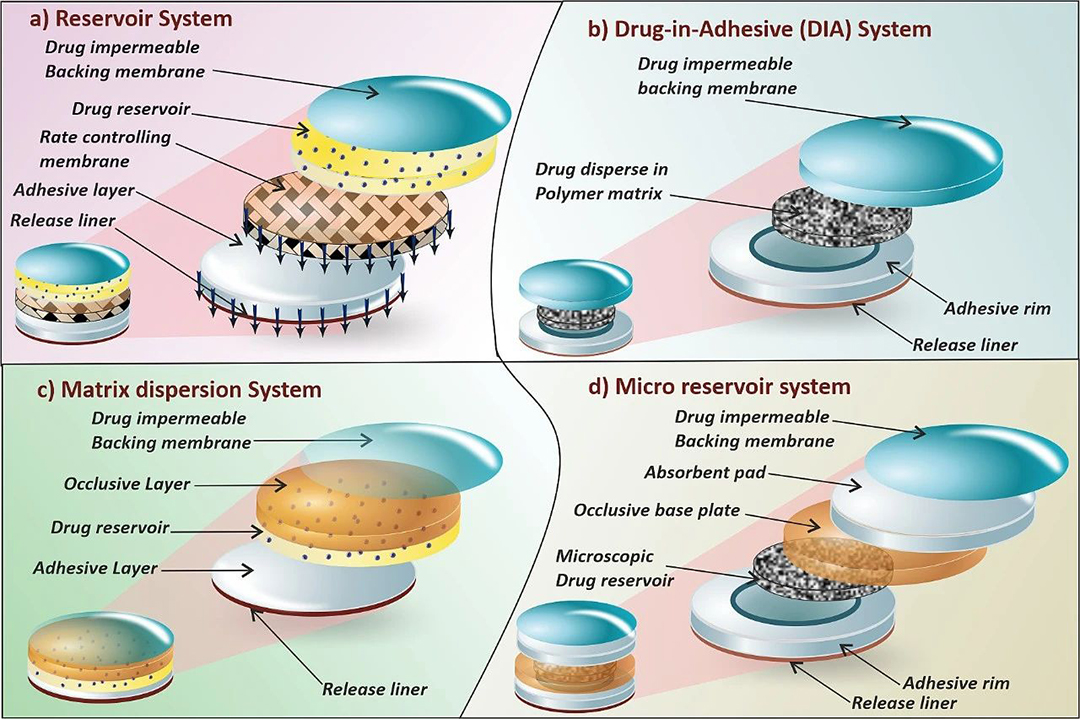
图3. (a) 储库系统,(b) 黏胶分散型系统,(c) 聚合物骨架型系统,(d) 微储库系统。
第二种方法是骨架型系统(matrix system),进一步分为两类,即黏胶分散型(DIA)系统和聚合物骨架型系统(matrix dispersion system)。在 DIA (Drug-in-adhesive)系统中,药物分散到胶黏剂聚合物中形成药物储库,如图3(b)所示。药物在含药胶黏剂聚合物上的分散是通过利用溶剂浇铸或熔融等技术完成的。将不含药物的胶黏剂聚合物涂覆在储库上。DIA 基质和储库基质之间的差异见表2。
在聚合物骨架型(亦称“基质分散型”)系统中,药物均匀分散在亲水性或亲脂性基质中,然后固定在由药物不可渗透的背衬层制成的隔室中的闭合基板上。聚合物骨架型系统的不同隔室如图3(c)所示。微贮库系统是聚合物骨架型系统和储库系统的集成,如图3(d)所示。药物储库使用水溶性聚合物溶液制成,其中药物呈悬浮状。之后,药物悬浮液均匀分散在亲脂性聚合物中,形成许多微观药物储库球体。通过原位交联聚合物,热力学不稳定的分散体迅速稳定。
渗透速率/通量的评估方法
在古代医学文献中,药物的外用治疗或美容功效已被记录。药物通过皮肤传递的潜力是基于皮肤吸收的基本原理。深入研究皮肤在药物吸收过程中的作用,以及理解这一过程的机制,对于经皮药物输送系统至关重要。经皮吸收是药物分子穿过皮肤各层并进入体循环的过程。这一过程包括渗透、药物分布、扩散、穿透和吸收等连续步骤。
体外方法
在体外实验中,快速且经济的策略被采用以评估药物分子穿越人工或生物膜的渗透性。本节将详细探讨多种扩散池类型以及它们所采用的多样化膜材料。
扩散池
扩散细胞,作为制药和化妆品行业筛选药物/物质吸收或渗透的体外工具,首次由 Dr. Thomas J. Franz 于1970年引入。自那时起,它们已被广泛应用于评估经皮药物输送系统(TDDS)的药物渗透特性。这种装置一般由三个主要部分组成:供给室、药物渗透膜和接收室。
Franz 扩散池
Franz 扩散池可分为静态和流通池(flow-through cell diffusion cell)两种类型。对于 fixed type of diffusion cell 而言,接收液在实验过程中仅部分被替换;但对流通池而言,其接收液是不断被新的接收介质替换。就供给室而言,可以是开放式的(基于大气压进行测量),也可以是封闭式的(由于压力较高而具有更高的渗透性)。Sebe 等人在 2022 年设计了一种新型的立式扩散池,该扩散池具有多种优势,如在提样补液过程中可避免气泡产生,便于组装和清洁等。
夹套式 Franz 扩散池(Jacketed Franz diffusion cell)
夹套式 Franz 扩散池是 Franz 扩散池的改良版本,其特点是在扩散池外围增设了一个装满水的夹套室,这使得该装置能够维持一个恒定的温度条件。这种设计显著提升了渗透性能,包括渗透通量和系数。
并排扩散池(Side-by-side diffusion cell)
扩散池由水平排列的供给室和接收室构成,这些扩散池具有相同的体积和搅拌速率。与其他类型的扩散池相比,该方法对供给室和接收室之间安装的膜具有破坏性,因为皮肤过度水合,导致试验药物的渗透率异常增加。
流通池(Flow-through cell)
A flow-through cell is similar to other types of diffusion cells with an additional benefit of connection to an autosampler system, in which frequent sampling can be carried out as the circulating media replaces the receptor fluid on a continuous basis.
皮肤芯片装置
该设备为药物测试提供了一个创新的解决方案,它模拟了真实皮肤的特性,有望成为替代动物模型的有力候选。通过数学建模和计算流体动力学(CFD),可以预测药物在皮肤真皮层的扩散和热量传递过程。该设备的设计精巧,由三个关键组件构成:基于聚合物的微流体通道、微流体通道周围的框架结构,以及用于固定膜或皮肤样品并将其插入微流体扩散室的样品架。这种芯片上的皮肤微流体平台,不仅经济高效,而且为药物筛选提供了一种可靠的方法,其优势在于能够实现扩散装置的小型化。目前,该设备与机器人系统的结合,用于制药行业的中等通量药物筛选,正处于技术验证和优化的关键阶段。
各种渗透膜
人工膜
人造膜或合成聚合物膜能够模拟皮肤屏障的功能,并且避免了生物变异的问题。这些膜由于不具有人类或动物皮肤的特性,因此它们被广泛用于研究药物释放机制。人造皮肤膜的常见类型包括基于脂质囊泡的膜、聚砜、纤维素、聚二甲基硅氧烷、聚醚砜和聚烯烃,例如Strat-M®膜。
人体皮肤等效物(HSE)
人体皮肤等效物(HSE)是一种由皮肤细胞构成的三维生物工程结构。它们主要分为两种形式:重构人表皮(RHE)和全层皮肤模型(FT)。RHE 模型只包含表皮层,而 FT 模型则同时包含表皮和真皮层。市场上常见的 RHE 产品有EpiDerm™、Episkin、SkinEthic等,而 FT 产品则包括 EpiDermFT®、Vitrolife-Skin™、GraftSkin®等,这些产品均可在市场上购买到。
哺乳动物皮肤
哺乳动物的皮肤样本,无论是离体人类还是尸体皮肤,均可作为体外渗透性研究的标准材料(依据 OECD 指南 428 和世界卫生组织 EHC 235)。然而,鉴于人类皮肤资源的稀缺性,其他动物的皮肤,例如猪、鼠或豚鼠的皮肤,可以作为替代品。
离体方法
主要包括胶带剥离法、共聚焦激光扫描显微镜(CLSM)以及共聚焦拉曼光谱(CRS),本节以下部分对其进行讨论。
胶带剥离方法
In this method, the stratum corneum (SC) is removed by repeatedly applying adhesive tape on the surface of the skin so that the adhesive tape strips off the skin barrier to some extent. It has been widely used for dermatopharmacokinetics study and drug penetration depth for topical as well as transdermal formulations.
在这种技术中,通过在皮肤表面反复粘贴和移除胶带,实现了角质层(SC)的去除,从而使胶带在一定程度上剥离了皮肤屏障。这种方法已被广泛应用于皮肤药代动力学研究以及局部和透皮药物制剂的渗透深度研究。
共聚焦激光扫描显微镜(CLSM)技术
CLSM 技术能够追踪药物通过皮肤途径的传输过程,并且已经被广泛地应用于多个领域,例如药物与皮肤相互作用的研究、药物对皮肤的渗透深度的评估,以及不同渗透增强剂的效果分析。Abdel-Hafez 等人在 2018 年利用 CLSM 技术对姜黄素纳米粒子的透皮渗透路径进行了追踪。在这项技术中,进行了荧光标记的纳米粒子悬浮液被用于渗透实验。此外,借助 CLSM,可以获取渗透程度和路径的视觉信息,从而证实了其在体内外实验中的适用性。
共聚焦拉曼光谱(CRS)技术
由于其高空间分辨率和化学敏感性,CRS在皮肤渗透研究中正在兴起。使用CRS可以获得局部用药的深度剖面,用于体内和体外研究。
体内模型
体内模型通过更精确的估计,揭示了药物通过皮肤吸收的程度。这些模型采用了多种技术,包括皮肤开放流微灌注、微透析以及直接测量药物与血浆的药代动力学和药效学反应。与现有方法相比,它们为药物对机体的影响提供了更深入的洞察。
本网站刊载的各类文章重在分享,尊重原创,如有侵权请联系我们(it@haigetang.com),我们将会在第一时间之内删除。



